&;Anna Bek 2006
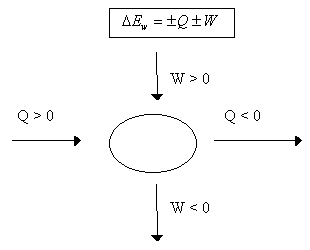
I zasada termodynamiki - przyrost energii wewnętrznej układu termodynamicznego w dowolnym procesie jest równy sumie pracy wykonanej nad układem przez siły zewnętrzne i dostarczonego do układu ciepła.

lub
|
|
(1) | |
Gdzie: |
|
Ciepło :
|
|
(2) | |
Gdzie: |
|
Równanie Clapeyrona
|
|
(3) | |
Gdzie: |
p - ciśnienie gazu, |
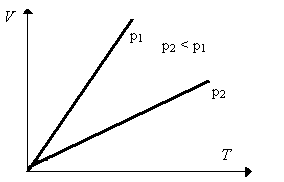
Prawo Gay'a Lussaca - w przemianie izobarycznej objętość danej masy gazu doskonałego jest wprost proporcjonalna do temperatury tego gazu.
|
|
(4) |
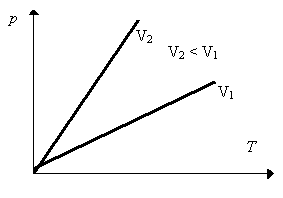
Prawo Charlesa - w przemianie izochorycznej ciśnienie danej masy gazu doskonałego jest wprost proporcjonalne do temperatury gazu.
|
|
(5) |
|
|
(6) |
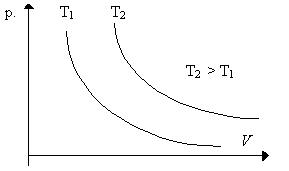
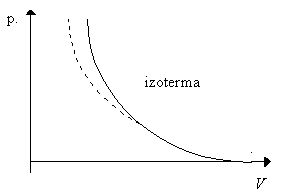
Prawo Boyle'a Mariotta - w przemianie izotermicznej ciśnienie danej masy gazu doskonałego jest odwrotnie proporcjonalne do objętości tego gazu.
|
T = const. |
(7) |
|
pV = const. |
(8) |
Równanie określające przemianę adiabatyczną nosi nazwę równania Poissona.
|
pV = const. |
(9) |
|
|
(10) |
|
|
(1) | |
Gdzie: |
p,V - ciśnienie i objętość gazu doskonałego, |
Silnik cieplny wykonuje pracę kosztem części ciepła pobranego ze źródła. Pracę każdego silnika można przedstawić jako zamknięty cykl przemian tzw. ciała roboczego. Sprawność silnika pracującego w dowolnym cyklu przemian :
|
|
(2) | |
Gdzie: |
Q1 - suma ciepeł pobranych ze źródła, |
W zamkniętym cyklu przemian podczas przynajmniej jednej z nich ciepło musi być oddane do chłodnicy dlatego sprawność każdego silnika cieplnego jest zawsze mniejsza niż 100 procent. Sprawność idealnego silnika Carnota można wyrazić przez różnicę temperatur bezwzględnych jego źródła i chłodnicy :
|
|
(3) | |
Gdzie: |
T - temperatura, |
II zasada termodynamiki - procesy w przyrodzie zachodzą w jednym kierunku od stanów mniej prawdopodobnych do stanów bardziej prawdopodobnych. Nie jest możliwe skonstruowanie silnika cieplnego pracującego cyklicznie, którego jednym rezultatem działania byłoby pobieranie ciepła ze źródła i wykonywanie równoważnej mu pracy.
Entropia - jest miarą nieuporządkowania ciała lub układu ciał. Jest funkcją stanu ciała lub układu, oznacza to że, układ pozostający w określonym stanie ma określoną entropię niezależnie od tego, w jaki sposób został do tego stanu doprowadzony.
|
|
(4) | |
Gdzie: |
d S - przyrost entropii układu odizolowanego, który w odwracalnym procesie małej zmiany stanu pobiera ciepło w temperaturze T, |